See all products
See all products
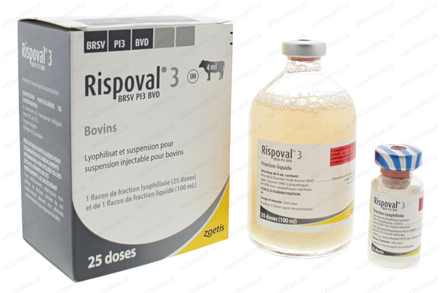
RISPOVAL 3 BRSV PI3 BVD 25 doses
RISPOVAL 3 BRSV PI3 BVD 25 doses
After validating your request, you will have acess to the price of this prescription drug. Learn more To get more information about this vet drug, contact a pharmacist by clicking here.
Product Description
Numbers marketing authorization (No. AMM):
FR/V/1611855 9/2003Code ATCVet:
QI02AHCIP:
8071057GTIN:
05414736031491Espèces cibles
Indications d'utilisation, en spécifiant les espèces cibles
- Immunisation active afin de :
. réduire l'excrétion virale et les signes cliniques dus au virus Pi3V,
. réduire l'excrétion virale du virus BRSV,
. réduire l'excrétion virale et la sévérité de la leucopénie consécutive à une infection par le virus BVD type 1.
Mise en place de l'immunité : 3 semaines après la vaccination.
Durée de l'immunité : 6 mois (démontrée par épreuve virulente) après la vaccination pour les virus BRSV et BVD type 1. La durée d'immunité n'a pas été établie pour le virus bovin Pi3.
L'efficacité sur les souches de virus BVD de type 2 n'a pas été démontrée.
Posologie et voie d'administration
Species
CattleType of medication
ImmunologicalActive substance
bovine parainfluenza virus bovine viral diarrhea virus bovine respiratory syncytial virusRoute of administration
IntramuscularPrescription ?
Issuance on prescriptionConditions of drug dispensing
Vaccine : dispensing on prescriptionPharmaceutical form
Lyophilisate & suspension for injectable suspensionContre-indications
Mises en garde particulières à chaque espèce cible
Précautions particulières d'emploi chez l'animal
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Autres précautions
Effets indésirables (fréquence et gravité)
Utilisation en cas de gravidité, de lactation ou de ponte
Interactions médicamenteuses et autres formes d'interactions
Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Temps d'attente
Incompatibilités
Durée de conservation
Durée de conservation après reconstitution conforme aux instructions : 2 heures.
Précautions particulières de conservation
Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Composition qualitative et quantitative
Une dose de lyophilisat contient :
Substance(s) actives :
Virus Parainfluenza 3 (PI3V), souche RLB 103, ………..vivante atténuéeentre 105,0 et 108,6 DICC50(*)
Virus Syncitial Respiratoire Bovin (BRSV), ..…………….souche 375 vivante atténuée,entre 105,0 et 107,2 DICC50(*) (*)DICC50 : dose infectant 50 % des cultures cellulaires.
Une dose de 4 ml de suspension contient :
Substance(s) active(s) :
Virus de la Diarrhée Virale Bovine (BVD) ………………..type I souches 5960 (cytopatique) et6309 (non cytopatique) inactivéesinduisant un titre séroneutralisant moyenchez le cobaye d’au moins 3,0 log2
Adjuvant :
Alhydrogel 2 % ..…………………………………………….0,8 ml (équivalent à 24,36 mg d’hydroxyde d’aluminium) Pour la liste complète des excipients, voir rubrique «Liste des excipients».
Liste des excipients
Gélatine
Hydrolysat de caséine
Milieu HALS
Alhydrogel 2 %
Dénomination du médicament vétérinaire
Composition qualitative et quantitative
Une dose de lyophilisat contient :
Substance(s) actives :
Virus Parainfluenza 3 (PI3V), souche RLB 103, ………..vivante atténuéeentre 105,0 et 108,6 DICC50(*)
Virus Syncitial Respiratoire Bovin (BRSV), ..…………….souche 375 vivante atténuée,entre 105,0 et 107,2 DICC50(*) (*)DICC50 : dose infectant 50 % des cultures cellulaires.
Une dose de 4 ml de suspension contient :
Substance(s) active(s) :
Virus de la Diarrhée Virale Bovine (BVD) ………………..type I souches 5960 (cytopatique) et6309 (non cytopatique) inactivéesinduisant un titre séroneutralisant moyenchez le cobaye d’au moins 3,0 log2
Adjuvant :
Alhydrogel 2 % ..…………………………………………….0,8 ml (équivalent à 24,36 mg d’hydroxyde d’aluminium) Pour la liste complète des excipients, voir rubrique «Liste des excipients».
Forme pharmaceutique
Espèces cibles
Indications d'utilisation, en spécifiant les espèces cibles
- Immunisation active afin de :
. réduire l'excrétion virale et les signes cliniques dus au virus Pi3V,
. réduire l'excrétion virale du virus BRSV,
. réduire l'excrétion virale et la sévérité de la leucopénie consécutive à une infection par le virus BVD type 1.
Mise en place de l'immunité : 3 semaines après la vaccination.
Durée de l'immunité : 6 mois (démontrée par épreuve virulente) après la vaccination pour les virus BRSV et BVD type 1. La durée d'immunité n'a pas été établie pour le virus bovin Pi3.
L'efficacité sur les souches de virus BVD de type 2 n'a pas été démontrée.
Contre-indications
Mises en garde particulières à chaque espèce cible
Précautions particulières d'emploi chez l'animal
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Autres précautions
Effets indésirables (fréquence et gravité)
Utilisation en cas de gravidité, de lactation ou de ponte
Interactions médicamenteuses et autres formes d'interactions
Posologie et voie d'administration
Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Temps d'attente
Propriétés immunologiques
Code ATC-vet : QI02AH.
Stimulation d'une immunité active contre Pi3, BRSV et BVD Type 1.
Le vaccin induit une capacité de neutralisation croisée large vis-à -vis de diverses souches européennes actuelles de BVD Type I, comme mesuré in vitro par un test de neutralisation virale. Une neutralisation croisée de niveau moindre a également été mise en évidence vis-à -vis des souches BVD Type 2.
Liste des excipients
Gélatine
Hydrolysat de caséine
Milieu HALS
Alhydrogel 2 %
Incompatibilités
Durée de conservation
Durée de conservation après reconstitution conforme aux instructions : 2 heures.
Précautions particulières de conservation
Nature et composition du conditionnement primaire
Bouchon caoutchouc bromobutyle (flacon lyophilisat)
Bouchon caoutchouc chlorobutyle (flacon suspension)
Capsule aluminium
Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Titulaire de l'autorisation de mise sur le marché
23-25 AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
FRANCE
Numéro(s) d'autorisation de mise sur le marché
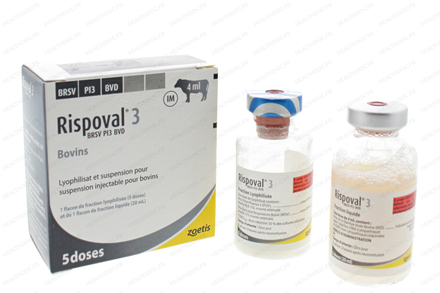
Boîte de 1 flacon de fraction lyophilisée (5 doses) et de 1 flacon de fraction liquide (20 ml)
Boîte de 1 flacon de fraction lyophilisée (25 doses) et de 1 flacon de fraction liquide (100 ml)
Toutes les présentations peuvent ne pas être commercialisées.
Date de première autorisation/renouvellement de l'autorisation
Date de mise à jour du texte
 See all products
See all products
Zoetis est une société mondiale de santé animale qui se consacre à aider ses clients et leurs entreprises de manière toujours plus efficace. Forts de 60 années d'expérience, nous fournissons des médicaments et des vaccins de qualité, complétés par des produits de diagnostic, des tests génétiques, des biodivoteurs et une gamme de services. Nous travaillons tous les jours pour mieux comprendre et relever les défis réels auxquels sont confrontés ceux qui élèvent et soignent les animaux d'une manière qu'ils jugent vraiment pertinente.
| The head office | United States (Madison) |
| Headquarters | PFIZER |
| Creation | 1952 |
| Type of company | publicly listed company (New York) |
| Ranking | 1st World Veterinary Laboratory |
| General Director (World) | Juan Ramón Alaix |
| General Director (France) | Dr Vanessa Dablin D'Aussonne |
| Workforce (World) | > 9'000 employees |
| Workforce (France) | 170 employees |
| Veterinary Delegates | > 3'500 employees |
| R&D Specialties | > 1'100 employees |
| Worldwide presence | > 100 countries |
| Number of manufacturing sites | 27 |
| Turnover (global) | $ 4.9 billion |
| Turnover (France) | € 130 million |
| Livestock | 64% of turnover |
| Pets | 36% of turnover |
| Species treated | 8 (cattle, pigs, poultry, sheep, fish, dogs, cats, horses) |
| Therapeutic Areas | 5 (vaccines, antiparasitics, antibiotics, medicated feeds and other pharmaceutical products) |
| Number of products | > 300 |
Marketing authorisation holder
ZOETIS FRANCE See more information
Espèces cibles
Indications d'utilisation, en spécifiant les espèces cibles
- Immunisation active afin de :
. réduire l'excrétion virale et les signes cliniques dus au virus Pi3V,
. réduire l'excrétion virale du virus BRSV,
. réduire l'excrétion virale et la sévérité de la leucopénie consécutive à une infection par le virus BVD type 1.
Mise en place de l'immunité : 3 semaines après la vaccination.
Durée de l'immunité : 6 mois (démontrée par épreuve virulente) après la vaccination pour les virus BRSV et BVD type 1. La durée d'immunité n'a pas été établie pour le virus bovin Pi3.
L'efficacité sur les souches de virus BVD de type 2 n'a pas été démontrée.
Posologie et voie d'administration
-
Species
Cattle -
Type of medication
Immunological -
Active substance
bovine parainfluenza virus bovine viral diarrhea virus bovine respiratory syncytial virus -
Route of administration
Intramuscular -
Prescription ?
Issuance on prescription -
Conditions of drug dispensing
Vaccine : dispensing on prescription -
Pharmaceutical form
Lyophilisate & suspension for injectable suspension -
Category
Veterinary drugs Immunity, Vaccines, Sera AHP Vaccines
Contre-indications
Mises en garde particulières à chaque espèce cible
Précautions particulières d'emploi chez l'animal
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Autres précautions
Effets indésirables (fréquence et gravité)
Utilisation en cas de gravidité, de lactation ou de ponte
Interactions médicamenteuses et autres formes d'interactions
Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Temps d'attente
Incompatibilités
Durée de conservation
Durée de conservation après reconstitution conforme aux instructions : 2 heures.
Précautions particulières de conservation
Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Composition qualitative et quantitative
Une dose de lyophilisat contient :
Substance(s) actives :
Virus Parainfluenza 3 (PI3V), souche RLB 103, ………..vivante atténuéeentre 105,0 et 108,6 DICC50(*)
Virus Syncitial Respiratoire Bovin (BRSV), ..…………….souche 375 vivante atténuée,entre 105,0 et 107,2 DICC50(*) (*)DICC50 : dose infectant 50 % des cultures cellulaires.
Une dose de 4 ml de suspension contient :
Substance(s) active(s) :
Virus de la Diarrhée Virale Bovine (BVD) ………………..type I souches 5960 (cytopatique) et6309 (non cytopatique) inactivéesinduisant un titre séroneutralisant moyenchez le cobaye d’au moins 3,0 log2
Adjuvant :
Alhydrogel 2 % ..…………………………………………….0,8 ml (équivalent à 24,36 mg d’hydroxyde d’aluminium) Pour la liste complète des excipients, voir rubrique «Liste des excipients».
Liste des excipients
Gélatine
Hydrolysat de caséine
Milieu HALS
Alhydrogel 2 %
Dénomination du médicament vétérinaire
Composition qualitative et quantitative
Une dose de lyophilisat contient :
Substance(s) actives :
Virus Parainfluenza 3 (PI3V), souche RLB 103, ………..vivante atténuéeentre 105,0 et 108,6 DICC50(*)
Virus Syncitial Respiratoire Bovin (BRSV), ..…………….souche 375 vivante atténuée,entre 105,0 et 107,2 DICC50(*) (*)DICC50 : dose infectant 50 % des cultures cellulaires.
Une dose de 4 ml de suspension contient :
Substance(s) active(s) :
Virus de la Diarrhée Virale Bovine (BVD) ………………..type I souches 5960 (cytopatique) et6309 (non cytopatique) inactivéesinduisant un titre séroneutralisant moyenchez le cobaye d’au moins 3,0 log2
Adjuvant :
Alhydrogel 2 % ..…………………………………………….0,8 ml (équivalent à 24,36 mg d’hydroxyde d’aluminium) Pour la liste complète des excipients, voir rubrique «Liste des excipients».
Forme pharmaceutique
Espèces cibles
Indications d'utilisation, en spécifiant les espèces cibles
- Immunisation active afin de :
. réduire l'excrétion virale et les signes cliniques dus au virus Pi3V,
. réduire l'excrétion virale du virus BRSV,
. réduire l'excrétion virale et la sévérité de la leucopénie consécutive à une infection par le virus BVD type 1.
Mise en place de l'immunité : 3 semaines après la vaccination.
Durée de l'immunité : 6 mois (démontrée par épreuve virulente) après la vaccination pour les virus BRSV et BVD type 1. La durée d'immunité n'a pas été établie pour le virus bovin Pi3.
L'efficacité sur les souches de virus BVD de type 2 n'a pas été démontrée.
Contre-indications
Mises en garde particulières à chaque espèce cible
Précautions particulières d'emploi chez l'animal
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Autres précautions
Effets indésirables (fréquence et gravité)
Utilisation en cas de gravidité, de lactation ou de ponte
Interactions médicamenteuses et autres formes d'interactions
Posologie et voie d'administration
Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Temps d'attente
Propriétés immunologiques
Code ATC-vet : QI02AH.
Stimulation d'une immunité active contre Pi3, BRSV et BVD Type 1.
Le vaccin induit une capacité de neutralisation croisée large vis-à -vis de diverses souches européennes actuelles de BVD Type I, comme mesuré in vitro par un test de neutralisation virale. Une neutralisation croisée de niveau moindre a également été mise en évidence vis-à -vis des souches BVD Type 2.
Liste des excipients
Gélatine
Hydrolysat de caséine
Milieu HALS
Alhydrogel 2 %
Incompatibilités
Durée de conservation
Durée de conservation après reconstitution conforme aux instructions : 2 heures.
Précautions particulières de conservation
Nature et composition du conditionnement primaire
Bouchon caoutchouc bromobutyle (flacon lyophilisat)
Bouchon caoutchouc chlorobutyle (flacon suspension)
Capsule aluminium
Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Titulaire de l'autorisation de mise sur le marché
23-25 AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
FRANCE
Numéro(s) d'autorisation de mise sur le marché
Boîte de 1 flacon de fraction lyophilisée (5 doses) et de 1 flacon de fraction liquide (20 ml)
Boîte de 1 flacon de fraction lyophilisée (25 doses) et de 1 flacon de fraction liquide (100 ml)
Toutes les présentations peuvent ne pas être commercialisées.
Date de première autorisation/renouvellement de l'autorisation
Date de mise à jour du texte
 See all products
See all products
Zoetis est une société mondiale de santé animale qui se consacre à aider ses clients et leurs entreprises de manière toujours plus efficace. Forts de 60 années d'expérience, nous fournissons des médicaments et des vaccins de qualité, complétés par des produits de diagnostic, des tests génétiques, des biodivoteurs et une gamme de services. Nous travaillons tous les jours pour mieux comprendre et relever les défis réels auxquels sont confrontés ceux qui élèvent et soignent les animaux d'une manière qu'ils jugent vraiment pertinente.
| The head office | United States (Madison) |
| Headquarters | PFIZER |
| Creation | 1952 |
| Type of company | publicly listed company (New York) |
| Ranking | 1st World Veterinary Laboratory |
| General Director (World) | Juan Ramón Alaix |
| General Director (France) | Dr Vanessa Dablin D'Aussonne |
| Workforce (World) | > 9'000 employees |
| Workforce (France) | 170 employees |
| Veterinary Delegates | > 3'500 employees |
| R&D Specialties | > 1'100 employees |
| Worldwide presence | > 100 countries |
| Number of manufacturing sites | 27 |
| Turnover (global) | $ 4.9 billion |
| Turnover (France) | € 130 million |
| Livestock | 64% of turnover |
| Pets | 36% of turnover |
| Species treated | 8 (cattle, pigs, poultry, sheep, fish, dogs, cats, horses) |
| Therapeutic Areas | 5 (vaccines, antiparasitics, antibiotics, medicated feeds and other pharmaceutical products) |
| Number of products | > 300 |
Marketing authorisation holder
ZOETIS FRANCE See more information
More about this product
More about this product
This product does not have any reviews yet
Questions (0)
Ask a questionThis product does not have any Questions and Answers yet
Reviews 0
Questions 0